Il Regolamento MDR 2017/745
nota n.1 del 27 Maggio 2021 a cura di Sebastiano Lodi
EUDAMED e UDI – Date di Applicazione
Il Regolamento MDR 2017/745 ha completato il “periodo di transizione” ed entrerà in vigore (pur con alcune deroghe note per quanto riguarda, per esempio, i dispositivi medici marcati CE in accordo alla Direttiva 93/42/CEE con un certificato valido, o i dispositivi di classe I in Direttiva che dovranno essere riclassificati in accordo al Regolamento) dal 26 maggio 2021.
In tale contesto siamo a rispondere ad alcuni dubbi legati alle date di entrata in vigore degli obblighi di registrazione sulla banca dati EUDAMED e sugli obblighi di riportare il codice UDI sulle etichette dei prodotti
EUDAMED
EUDAMED è la banca dati europea per gli operatori economici in ambito dispositivi medici ed è strutturata in 6 moduli interconnessi che saranno accessibili / consultabili tramite un sito web. I sei moduli sono:
- Actors registration
- UDI/Devices registration
- Notified Bodies and Certificates
- Clinical Investigations and performance studies
- Vigilance and post-market surveillance
- Market Surveillance.
Dal 1° dicembre 2020 è attivo il modulo “actors registration”.
Gli operatori economici (FABBRICANTI, MANDATARI, IMPORTATORI, ASSEMBLATORI DI KIT/SISTEMI) dovranno registrarsi nel modulo “actors registration” per ricevere il numero SRN.
Per i DISTRIBUTORI ad oggi non è prevista alcuna registrazione in EUDAMED.
La registrazione, al momento (es. dal 27 maggio 2021) NON E’ OBBLIGATORIA in Italia; la registrazione sarà obbligatoria solo da quando EUDAMED sarà completamente operativa come riportato sulla pagina web di EUDAMED:
The first module of EUDAMED: Actor registration was made available on 1 December 2020. The Commission is not in a position to require the use of the module until EUDAMED is fully functional according to the Medical Device Regulation (MDR) and additional national requirements on registrations can therefore not be excluded. A MDCG Position Paper on the use of the EUDAMED actor registration module and of the Single Registration Number (SRN) in the Member States was published in August 2020.
(nota: EUDAMED non sarà operativa nel 2021; lo sarà probabilmente nel Maggio 2022 o ancora più in là).
A conferma di quanto indicato sopra, la guidance MDCG 2020-15 riporta quanto segue:
In accordance with Article 30(1) MDR, the actor registration module shall allow for the creation of a unique single registration number (‘SRN’) referred to in Article 31(2) and to collate and process information that is necessary and proportionate to identify the manufacturer (including producers of system/procedure packs) and, where applicable, the authorised representative and the importer. As such, the actor registration module forms a prerequisite for the use of the other EUDAMED modules and facilitates a secure way of accessing EUDAMED. The responsibility to assign SRNs to economic operators lies with the Member States. To that end, Article 31(2) stipulates that, after having verified and validated the data entered by an economic operator, the competent authority of a Member State shall obtain an SRN from the actor registration module and approve the issuing of it to the requesting manufacturer, authorised representative or importer
On 30 October 2019, the Commission published a notice by which it concluded that the full functionality of EUDAMED requires the availability and full operation of all six modules in accordance with the technical specifications and confirmed by an audit as referred to in Article 34. The notice foresees the launch of a fully functional EUDAMED for May 2022.
In conclusione, come riportato sul sito di EUDAMED e nella guidance MDCG 2020-15, la registrazione in EUDAMED (come fabbricante, mandatario, importatore, assemblatore di kit/sistemi) non è obbligatoria entro il 26 maggio 2021.
Non risultano, al momento, nemmeno disposizioni nazionali specifiche da parte del Ministero della Salute italiano, che indichino l’obbligatorietà di tale registrazione per gli operatori economici (Fabbricanti, Mandatari, Importatori, Assemblatori di Kit/sistemi) italiani.
Ad oggi inoltre non risulta ancora registrata in EUDAMED alcuna organizzazione italiana, proprio perché l’Autorità Competente italiana (come altre Autorità Competenti europee) non ha ancora completato la procedura di assegnazione dell’ SRN; altre Autorità Competenti europee hanno invece già iniziato la procedura (per questo troviamo alcune aziende straniere già registrate in EUDAMED).
Ovviamente, la registrazione in EUDAMED è un prerequisito per l’utilizzo degli altri moduli di EUDAMED (quando saranno disponibili; per esempio il modulo relativo alla Vigilanza da utilizzare per la comunicazione di incidenti), pertanto è consigliabile provvedere alla registrazione dell’organizzazione quanto prima, specificatamente anche prima del Maggio 2022.
UDI – Date di Implementazione
L’UDI (Unique Device Identifier) è una serie di caratteri (numerica / alfanumerica) creata seguendo una codifica standard “globally accepted”. La serie di caratteri è generalmente accompagnata da un sistema di lettura digitale (es. codice a barre).
Ogni dispositivo medico dovrà riportare il proprio codice UDI, che si compone di UDI-DI + UDI-PI. Questi compaiono sul dispositivo stesso o sul packaging/labelling del dispositivo.
E’ richiesto poi il BASIC UDI-DI, che non compare sul dispositivo né sul packaging/labelling del dispositivo; il BASIC UDI-DI è destinato a identificare dispositivi con stessi “intended purpose”, classe di rischio e caratteristiche essenziali di progettazione e produzione.
E’ importante precisare che:
- I requisiti relativi all’UDI non si applicano ai “legacy devices” (es. dispositivi conformi a Direttiva MDD);
- La tabella di seguito riporta le date di applicazione dei codici UDI (UDI carrier) sui dispositivi conformi a MDR 2017/745.
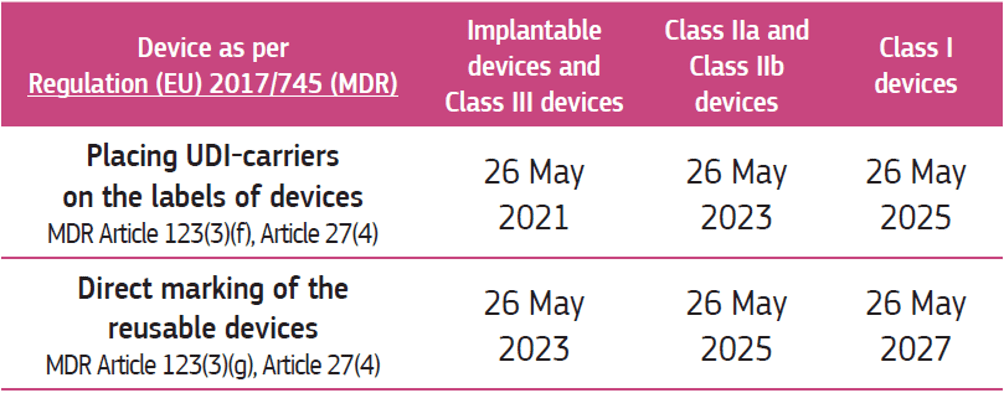
Note:
- le informazioni riportate sono aggiornate al 26 maggio 2021;
- le informazioni relative ad EUDAMED sono tratte dal sito web di EUDAMED e dalla guidance MDCG 2020-15 (agosto 2020);
- le informazioni relative a UDI sono tratte da Frequently Asked Questions and Answers su UDI ( 01-08-2020).

